Herzaktion, Rolle der Elektrolyte
ÜbersichtArbeitsmyokard
Kardiomyozyten des Erregungsbildungssystems
EKG und Elektrolyte
Übersicht
Der überwiegende Teil der Masse des Arbeitsmyokards sind Kardiomyozyten. Diese sind nicht selbstständig zur Erregung fähig. Sie müssen durch elektrische Erregungswellen, die von den Zellen des Erregungsbildungssystems erzeugt werden, angeregt werden. Bei den Zellen des Erregungsbildungs- und -leitungssystems handelt es sich um spezielle Kardiomyozyten. Der wesentliche Unterschied zu den Zellen des Arbeitsmyokards sind besondere Ionenkanäle und Transporter in der Zellmembran.
Das Herz ist eine Doppelpumpe, die das Blut durch die Gefäße treibt. Es besteht aus zwei Teilherzen: linkes und rechtes Herz. Das rechte pumpt das Blut durch den kleinen Kreislauf (Lungenkreislauf), das linke pumpt es durch den großen Kreislauf (Körperkreislauf).
Um ihre Funktion korrekt ausüben zu können, müssen beide Teilherzen synchronisiert werden. Diese Synchronizität wird durch einen Schrittmacher gewährleistet. Da der Schrittmacher im rechten Vorhof sitzt, kommt es zu verzögerten Erregungen in den unterschiedlichen Teilen des Herzens. Dennoch gelingt eine quasi synchrone Aktivität beider Teilherzen in Bezug auf die mechanische Herzaktion.
Ursache hierfür sind unterschiedliche elektrische Eigenschaften aller Teile des Erregungsbildungs- und Erregungsleitungssystems sowie der verschiedenen Anteile des Arbeitsmyokards. Auch hier sorgen unterschiedliche Ionenkanäle für verschiedene Erregungsbildungs- und Erregungsleitungseigenschaften.
Dabei gilt: Zellen des Erregungsbildungssystems besitzen kein stabiles Ruhemembranpotential, sie depolarisieren (erregen) spontan. Arbeitsmyokardzellen hingegen besitzen ein stabiles Ruhemembranpotential.
Arbeitsmyokard
Ruhemembranpotential und Erregungsausbreitung
Unerregte Zellen des Arbeitsmyokards weisen in Ruhe ein Membranpotential von -90 mV auf. Dieses entspricht annähernd, aber nicht exakt, dem Kalium-Gleichgewichtspotential. Die Kaliumleitfähigkeit wird im Ruhezustand durch den Kaliumeinwärtsgleichrichter (Kir) bestimmt. Dieser Kanal wird bei Depolarisation auf Werte positiver als -70 mV inaktiviert, bei Hyperpolarisation steigt seine Leitfähigkeit. Je stärker die Leitfähigkeit für Kalium ist, desto mehr nähert sich das Ruhemembranpotential dem Kalium-Gleichgewichtspotential. In Ruhe bedingt dieser Kanal somit, dass das Ruhemembranpotential dem Kalium-Gleichgewichtspotential annäherend gleich ist. Es ist jedoch etwas positiver, da noch eine geringe Leitfähigkeit für Natrium- und Calciumionen gegeben ist. Abhängig von den Umständen kann auch eine Leitfähigkeit für Chloridionen bestehen.
Voraussetzung für die Funktion des Arbeitsmyokards ist die elektrische Erregung der Zellmembranen. Physiologisch ist der primäre Schrittmacher der Sinusknoten im rechten Vorhof. Dessen Zellen (siehe unten) depolarisieren selbstständig.
Exkurs:
Der Sinusknoten besteht aus zwei Zelltypen: P-Zellen (P = pacemaker) und T-Zellen (Transitionszellen). Die P-Zellen liegen im Zentrum in Gruppen angeordnet und sind von Bindegewebshüllen umgeben. T-Zellen verbinden die P-Zellen mit dem umliegenden Arbeitsmyokard.
P-Zellen besitzen unter anderem die Connexine 45 und 40, T-Zellen das Connexin 43. Von diesen drei hat das Connexin 45 den geringsten elektrischen Leitwert (Kehrwert des Ohm'schen Widerstandes), sodass nur starke und synchrone Ströme fortgeleitet werden. Ströme wiederum gelangen normalerweise nur von Connexin 40- zu Connexin 43-enthaltenden Zellen, sodass eine rückläufige Erregung des Sinusknotens vermutlich nicht möglich ist.
Dies ist insofern bedeutend, als dass die einzelnen P-Zellen im Sinusknoten nicht synchron arbeiten. Nur dann, wenn größere Gruppen von Zellen gemeinsam gleichzeitig erregen, ist deren Strom stark genug, um über das Connexin 45 fortgeleitet zu werden, sodass die anderen Depolarisationen innerhalb der P-Zell-Population überlagert werden.
Es wird also diejenige P-Zelle zum Taktgeber, die am schnellsten das Schwellenpotential erreicht.
Der Sinusknoten als primärer Schrittmacher arbeitet also innerhalb seiner Zellpopulationen asynchron, wobei die jeweils stärkste Depolarisationsfront weitergeleitet wird. Bedingt durch die spezifischen Verläufe der Aktionspotentiale und der entsprechenden Refraktärzeiten ergibt sich nach außen ein synchrones Erregungsmuster des Sinusknotens.
Die Erregungswelle geht von den randständigen Zellen des Sinusknotens zunächst auf die benachbarten Zellen des Arbeitsmyokards über. Dabei werden die ruhenden Arbeitsmyokardzellen elektrisch erregt. Da alle Zellen des Arbeitsmyokards über gap junctions verbunden sind, ergibt sich folgender Funktionsmechanismus: über der Zellmembran kommt es zur Ladungsverschiebung. Diese Ladungsverschiebung wird über die gap junctions fortgeleitet. Dabei wirken die gap junctions wie das Schließen eines Stromkreises. Nun liegen (modellhaft betrachtet) zwei Zellen, die über gap junctions verbunden sind, vor, wobei eine Zelle außen eine negative Ladung hat und die andere außen eine positive. Da der Stromkreis geschlossen wurde, muss zum Ausgleich auch die andere, bisher nicht erregte Zelle, ihre Ladung über der Zellmembran ändern. Dies geschieht durch Ausgleichsströmchen (Hermann'sche Strömchentheorie). Auf dieser Grundlage kann sich eine Erregung fortleiten, da auch die Ausgleichsströmchen zu einer leichten Depolarisation führen.
Dies ist darin begründet, dass durch die Ausgleichsströmchen und die daraus folgende Positivierung des Membranpotentials die Ionenkanäle ihr Verhalten ändern. Das Ruhemembranpotential liegt bei -90 mV. Kommt es nun zur (leichten) Positivierung werden bei etwa -70 mV iK1-Kanäle inaktiviert und Natriumionenkanäle spannungsabhängig aktiviert. In der Folge kommt es zur Ausbildung eins Aktionspotentials der Herzmuskelzelle, was zu einer weiteren (leichten) Depolarisation bis zum kritischen Membranpotential führt, sodass sie ihrerseits ein Aktionspotential bilden, und so fort.
Aktionspotential
Die Ausbildung des Aktionspotentials gestaltet sich wie folgt (Abbildung 1). Durch Aktivierung einzelner Natriumionenkanäle kommt es zu einem schnellen Natriumeinstrom iNa (Phase 0 in der Abbildung). Dieser aktiviert weitere Natriumionenkanäle und durch positive Rückkopplung kommt es zu einer sehr schnellen Depolarisation.
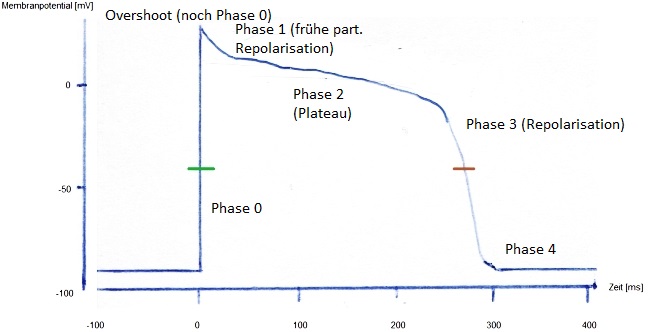 Abb. 1
Abb. 1Quelle: eigene Zeichnung
Durch die nun deutlich erhöhte Natriumleitfähigkeit strebt das Membranpotential in Richtung Natriumgleichgewichtspotential (+60 mV). Dieser Wert wird jedoch nicht erreicht. Bei etwa +20 mV stoppt die Depolarisation. Der Anteil der Vorderflanke des Aktionspotentials über 0 mV hinaus wird als Overshoot bezeichnet. Der Overshoot gehört noch zu Phase 0, die sich dem Overshoot anschließende partielle Repolarisation zu Phase 1.
Der Stopp der Depolarisation ist darin begründet, dass die Kanäle zwar sehr schnell öffnen, aber bereits bei -40 mV wieder spannungsabhängig inaktivieren.
Kurz vor Erreichen und während des Overshoots werden zwei weitere Kanäle geöffnet: ein Kaliumionenkanal und ein Chloridkanal.
Der Kaliumionenkanal sorgt für einen Kaliumausstrom (transienter Auswärtsstrom, ito) und der Chloridkanal (iCl) bedingt einen Chlorid-Einstrom. Bei letzterem ist zu berücksichtigen, dass ein Chlorideinstrom eine intrazelluläre Negativierung darstellt und damit repolarisierend wirkt. Beide Ströme führen zu einer schnellen kurzzeitigen Repolarisation, welche direkt auf den Overshoot folgt (Phase 1).
An diese Repolarisation schließt sich eine längere "Plateauphase" (Phase 2) an. In einigen Lehrbüchern wird diese tatsächlich als Plateau im Diagramm dargestellt, was jedoch falsch ist. Zu keiner Zeit ist das Membranpotential gleichbleibend. Es handelt sich also um kein echtes Plateau, sondern um ein relatives (!) Gleichgewicht verschiedener Ionenströme:
Ab einem Membranpotentail von -40 mV werden langsame spannungsabhängige L-Typ Calciumionenkanäle aktiviert (iCa, grüne Markierung). Sie öffnen langsam und bleiben lange offen. Der Natrium-getragene Einstrom dauert gerade mal eine Millisekunde, während der Calciumstrom deutlich länger anhält: zwischen 200 und 400 ms, abhängig von der Herzfrequenz und Lokalisation im Arbeitsmyokard (siehe unten).
Während der Plateauphase liegt also ein Gleichgewicht vor allem von iK und iCa vor. Kurz gesagt:
Das Plateau entsteht, weil sich depolarisierende und repolarisierende Ionenströme etwa die Waage halten.
Exkurs: In sehr geringem Maße sind auch ito und iCl am Gleichgewicht während der Plateauphase beteiligt.
Die graphische Darstellung ist so gewählt, dass erkennbar ist, dass das Membranpotential sich zwar langsam aber dennoch mit einer gewissen Stetigkeit verringert.
Wenn die Kalziumionenkanäle inaktivieren und Repolarisationsströme stärker werden, beginnt die letzte Phase des Aktionspotentials (Phase 3 in der Abbildung) - die Repolarisationsphase. Diese wird bedingt durch die Inaktivierung der Calciumkanäle und getragen vor allem von Kaliumströmen. Wichtigster Kanal-Typ ist der Kalium-Auswärtsgleichrichter (verzögerter Gleichrichter). Er bedingt iK.
Der Kalium-Auswärtsgleichrichter wird bei Depolarisation verzögert aktiv und führt zum Kaliumausstrom, was eine Repolarisation und anschließende (relative) Hyperpolarisation bewirkt. Dabei gibt es eine langsame Komponente (iKs), welche früher aktiv wird und eine schnelle Komponente (iKr), die später wirkt. Die Repolarisationsphase ist also durch eine erhöhte Kaliumleitfähigkeit gekennzeichnet, wodurch sich das Membranpotential wieder dem Kaliumgleichgewichtspotential nähert. Beide Komponenten inaktivieren im Verlauf der Phase und der Kalium-Einwärtsgleichrichter übernimmt.
Auf die Repolarisationsphase folgt die Ruhephase (Phase 4). Eine deutliche Nachhyperpolarisation, wie sie für Neuronen typisch ist, findet man bei Arbeitsmyokardzellen nicht.
Refraktärphase
Während der Plateauphase ist die Zelle elektrisch refraktär (= absolute Refraktarität), ein neues Aktionspotential kann nicht ausgelöst werden. Da die Länge der Plateauphase deutlich die der Einzelzuckung überwiegt, ist im Herzen weder eine Superpositionierung, noch eine Tetanisierung möglich.
Die Phase der absoluten Refraktarität endet bei etwa -40 mV (braune Markierung Abb. 1) - bei diesem Membranpotential verharren die spannungsgesteuerten Natriumionenkanäle im Zustand "geschlossen und nicht aktivierbar".
Repolarisiert die Zelle weiter, ist deren Öffnung prinzipiell wieder möglich. Im Bereich nur wenig negativer als -40 mV wäre demnach die Auslösung eines Aktionspotentials mit deutlich geringerer Amplitude, Anstiegssteilheit und Dauer möglich. Jedoch muss für die Auslösung eines Aktionspotentials überhaupt erstmal eine gewisse Anzahl an Natriumionenkanälen gleichzeitig aktiviert werden. Rechnerisch liegt also die Grenze der relativen Refraktarität bei negativer als -40 mV, funktionell müssen noch etwas negativere Werte erreicht werden, damit überhaupt ein Aktionspotential zustande kommt. Zudem sind die Aktionspotentiale deformiert ("vergammelte" Aktionspotentiale, Abb. 2). Während dieser Phase ist daher die Erregbarkeit und auch die Form der Aktionspotentiale im Arbeitsmyokard inhomogen ausgeprägt. Dies begünstigt die Entstehung von Arrhythmien in der Form einer kreisenden Erregung (= vulnerable Phase, T-Welle im EKG, Abb. 4).
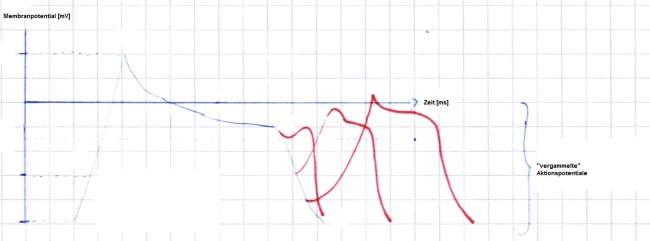 Abb. 2
Abb. 2Quelle: eigene Zeichnung
Die bisher genannten Kanäle stellen die wichtigsten und mit am besten erforschten dar. Es gibt jedoch noch deutlich mehr Kanäle und Ströme, die jedoch z.T. quantitativ weniger bedeutend sind.
Länge der Aktionspotentiale im Arbeitsmyokard der Vorhöfe und Kammern
Die Plateauphase der Aktionspotentiale im Vorhofmyokard ist kürzer als im Kammermyokard.
Zunächst beginnt sich die Erregung über die Vorhöfe auszubreiten. Diese Erregung erreicht mit einer Verzögerung die Kammern. Bedingt dadurch, dass die Repolarisation in den Vorhöfen früher beginnt als in den Kammern und weil die Plateauphase kürzer ist, sind die Vorhöfe für den nächsten Herzzyklus rechtzeitig wieder erregbar.
Kardiomyozyten des Erregungsbildungssystems
Die Zellen des Erregungsbildungssystems sind zur eigenständigen Bildung von Aktionspotentialen in der Lage. Eine Erregung von außen ist nicht notwendig. Es wurde bereits angedeutet, dass der molekularbiologische Unterschied in den verschiedenen Expressionsmustern von Ionenkanälen besteht. Im Folgenden sollen die Zellen des Sinusknotens betrachtet werden.
Während in Arbeitsmyokardzellen iK1 und iNa wichtige Ströme darstellen, sind diese in Schrittmacherzellen des Sinusknotens funktionell unbedeutend. Stattdessen werden zwei Kanaltypen exprimiert, die in Arbeitsmyokardzellen praktisch nicht zu finden sind: Ein Kanal für den Strom if sowie ein anderer T-Typ-Kalziumkanal (iCaT).
Das Aktionspotential einer Schrittmacherzelle läuft in einem andauernden Zyklus ab und gestaltet sich wie folgt (Abb. 3, weiter unten):
Der verzögerte Gleichrichter iK, der in Arbeitsmyokardzellen die Repolarisation bedingt, ist auch in Schrittmacherzellen dafür verantwortlich. Am Ende eines Zyklus wird dadurch die Repolarisation eingeleitet. Der verzögerte Gleichrichter inaktiviert dann jedoch bei zunehmend negativem Membranpotential. Die Depolarisation erreicht einen "negativsten" Wert (maximales diastolisches Potential = MDP) bei etwa -60 mV. Diese Depolarisation bzw. relative Hyperpolarisation führt zur Öffnung eines spannungsabhängigen Ionenkanals, welcher bei Hyperpolarisation aktiviert wird und zum Strom if führt (Punkt 1 und 2 in Abb. 3). Es handelt sich dabei um eine langsame diastolische Depolarisation (LDD). Das "f" steht für funny wegen seines abweichenden Verhaltens, da er bei Hyperpolarisation aktiviert und eine Depolarisation einleitet.
Exkurs:
Das Kanalprotein wird auf dem Gen HCN-4 kodiert. HCN steht für 'hyperpolarization-activated cyclic nucleotide-gated cation channel'. Es handelt sich dabei um einen unselektiven Kationenkanal, der auch Natriumionen durchlässt.
Die Gene HCN-1 bis HCN-3 kodieren für Kanäle, die sich unter anderem in Neuronen des gustatorischen Systems, der Retina und in Spermien finden. Zudem finden sich Populationen über das gesamte Zentralnervensystem verteilt, u.a. im Thalamus und dem Kleinhirn. Auch hier handelt es sich um unselektive Kationenkanäle, die jedoch vornehmlich Natriumströme tragen. Die pharmakologische Beeinflussung von HCN-Kanälen zur Modulation der Herzfunktion kann daher eine entsprechende Wirkung auf alle Organe haben, die HCN-Kanäle exprimieren.
Bei etwa -50 mV werden T-Typ-Kalziumionenkanäle geöffnet, welche einen schnellen Kalziumeinstrom iCaT bedingen (Punkt 3). Dieser trägt wesentlich zur (weiteren) Spontandepolarisation bei. Erreicht die Depolarisation einen Schwellenwert von etwa -40 mV (kritisches Membranpotential, KMP), wird der langsame Kalziumstrom (L-Typ) aktiv (iCaL, Punkt 4). Dadurch depolarisiert die Zelle weiter, bis sie ein Membranpotential von etwa +20 mV erreicht. In der depolarisierten Zelle wird nun der verzögerte Gleichrichter (iK) aktiv und leitet eine langsame Repolarisation ein (Punkt 5), im Zuge derer die L-Typ Kalziumkanäle inaktivieren. Das Membranpotential negativiert weiter, iK lässt nach, if setzt ein und der Zyklus beginnt von vorne.
Ein Plateau kann unter diesen Bedingungen nicht zustandekommen.
Unter Einfluss von Katecholaminen ist der Anstieg der LDD erheblich steiler (gepunktete Linie in der Abbildung).
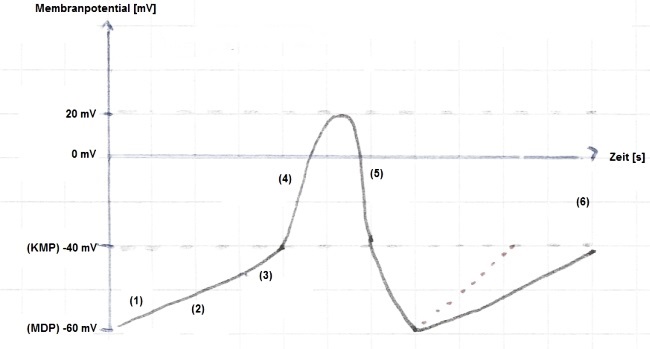 Abb. 3
Abb. 3Quelle: eigene Zeichnung
Exkurs:
Aktionspotentiale als phänomenologisches Merkmal
Die hier dargestellten Aktionspotentiale repräsentieren mit ihrer Morphologie den typischen Fall.
Zudem sind nur Ionenkanäle und Ströme genannt, die für den Potentialverlauf prinzipielle Bedeutung haben. In einer jeden Zelle (sowohl Kardiomyozyten als auch Neuronen und andere) sind nicht nur die Ionenkanäle an der Aufrechterhaltung bzw. dem Zustandekommen der Aktionspotentiale wesentlich beteiligt, sondern auch zahlreiche Transporter, allen voran die Natrium-Kalium-ATPase. Diese sorgen für die Aufrechterhaltung des ionalen Milieus, welches notwendig ist, um derartige Potentialbildungen überhaupt erst zu ermöglichen.
EKG und Elektrolyte
Spezifik des EKG
Die Verteilung und Wirkung der Elektrolyte ist eine notwendige Bedingung für die Ausbildung der Aktionspotentiale an einzelnen Zellen. Die Gesamtheit der elektrischen Aktivität des Myokards wird als Summationsvektor im EKG dargestellt. Die Aktivität der Zellen des Erregungsbildungs- und des Erregungsleitungssystems wird dabei nicht direkt abgebildet, da deren Zellmasse zu gering ist.
Im EKG werden jegliche mechanische Aktivitäten des Myokards weder gemessen oder erfasst. Wenngleich mechanische Einflüsse auf das Herz (z.B. Perikarderguss) im EKG zu Veränderungen führen können.
Das EKG erfasst die extrazelluläre elektrische Aktivität des Arbeitsmyokards.
Erkrankungen der einzelnen Wandschichten des Herzens (Myokard, Endokard, Perikard), Vitien, Klappenfehler usw. sowie andere globale Herzerkrankungen werden lediglich mittelbar im EKG repräsentiert und zwar nur insofern, als diese die Erregungsleitung im Arbeitsmyokard beeinträchtigen. Dies ist bei Ischämien und Nekrosen der Fall, da hier die Herzaktion nicht mehr physiologisch abläuft und ggf. gebildetes Narbengewebe oder Nekrosen ein abweichendes elektrisches Verhalten der Ionenströme bedingen können.
Obwohl Elektrolyte das Herz physiologisch unmittelbar beeinflussen, können deren Störungen nicht zuverlässig im EKG abgebildet werden. Elektrolyte wirken auf einzelne Zellen, Zellen beeinflussen sich gegenseitig und die Gesamtheit des Zellverbandes ergibt ein gemittelte Kurve (Stromkurvenverlauf des EKG). Das bedeutet, es wird der Bogen gespannt über Molekül - Zellmembran - Zelle - Organ.
Der Goldstandard zur Bestimmung der Elektrolytkonzentrationen im Blut ist die Untersuchung des Blutserums. Ein Fehlen von Anzeichen im EKG bedeutet nicht, dass keine Elektrolytstörung vorliegt, während das Vorliegen der typischen Zeichen einen Hinweis liefert, aber trotzdem nicht die Serumuntersuchung ersetzt. Manche Patienten zeigen bereits bei leichten Elektrolytstörungen die typischen EKG-Zeichen, während andere trotz einer schweren Elektrolytentgleisung einen EKG-Normalbefund haben.
Welchen Stellenwert hat das EKG in der Diagnostik?
«Das EKG ist einzig bei Herzrhythmusstörungen.»
Mit keinem anderen Verfahren können Herzrhythmusstörungen so sicher diagnostiziert werden wie mit dem EKG.
Sensitivität, Spezifität, positiv-prädiktiver Wert und negativ-prädiktiver Wert für Herzrhythmusstörungen im EKG beträgt näherungsweise 100%.
Das gilt unter der Voraussetzung, dass der EKG-Streifen hinreichend lang ist. Bei Erkrankungen, bei denen nur kurzzeitig (anfallsweise) Herzrhythmusstörungen bzw. EKG-Veränderungen auftreten, ist ggf. eine 24 h-Messung oder ein Event-Rekorder nötig, um sie zu erfassen.
Zustandekommen der EKG-Kurve (Spannungslinienkurve, "Stromlinienkurve")
Auf den folgenden Unterseiten dieses Projektes soll dargestellt werden, wie die einzelnen Elektrolyte an welcher Stelle Einfluss auf das EKG haben.
Die Herzaktion (Abb. 4) beginnt mit der Erregung im Sinusknoten, der zur Erregung des Arbeitsmyokards im rechten Vorhof und mit sehr geringer zeitlicher Verzögerung im linken führt. Die Spitze der P-Welle repräsentiert die halbe Erregung der Vorhöfe, das Ende der P-Welle die vollständige. Der schnelle Natriumeinstrom ist am Arbeitsmyokard der Kammern funktional Voraussetzung für einen QRS-Komplex. Natriumspiegel sowie Einflüsse auf Natriumionenkanäle sind daher bestimmend für die Breite des QRS-Komplexes.
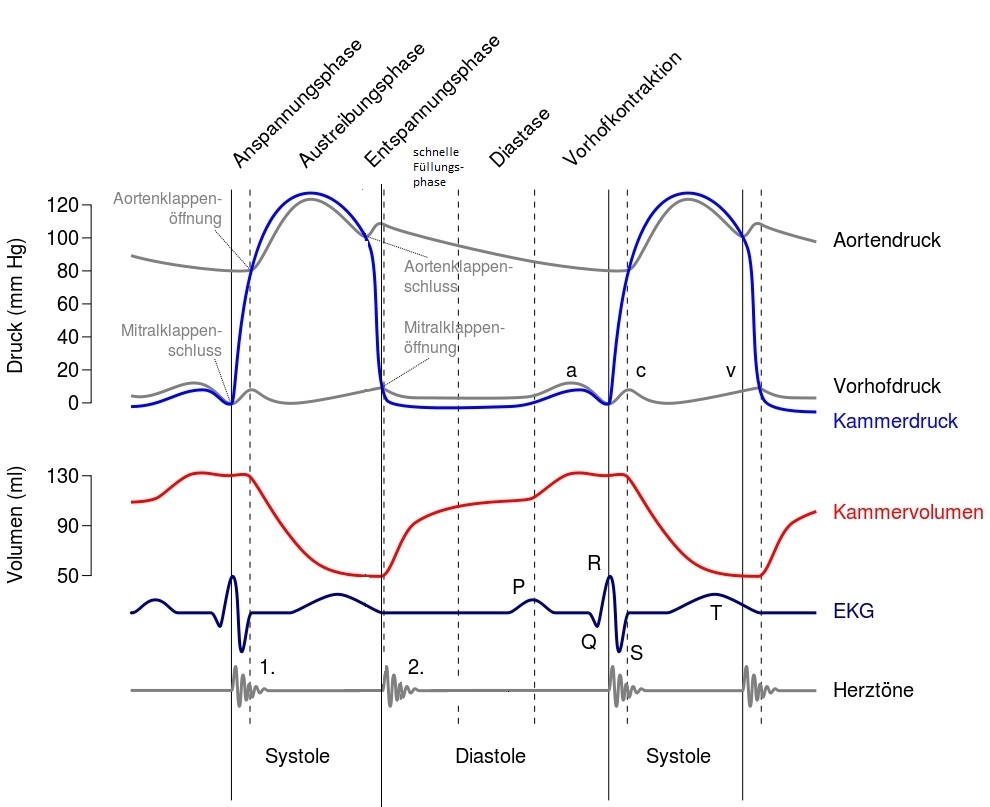 Abb. 4
Abb. 4Modifiziert nacht: "Wiggers Diagram de" von Wiggers_Diagram.svg: DanielChangMD revised original work of DestinyQx; Redrawn as SVG by xavaxderivative work: Dietzel65 - Diese Datei wurde von diesen Werken abgeleitet: Wiggers_Diagram.svg. Lizenziert unter Creative Commons Attribution-Share Alike 2.5 über Wikimedia Commons - http://commons.wikimedia.org/wiki/File:Wiggers_Diagram_de.svg#mediaviewer/File:Wiggers_Diagram_de.svg
CC Lizenz: http://creativecommons.org/licenses/by-sa/2.5/
Greift die Erregung auf das Kammerseptum über, führt dies zur Bildung der Q-Zacke. Sind die Ventrikel zur Hälfte erregt, zeigt das EKG den größten Ausschlag, nämlich den Gipfel der R-Zacke. Ein kurzer Verlauf in Richtung Herzbasis führt zur S-Zacke. Die Ventrikel sind nun vollständig erregt, der elektrische Summationsvektor beträgt Null und das EKG zeigt die ST-Strecke.
Das Ende des QRS-Komplexes bzw. der Anfang der ST-Strecke wird auch als J-Punkt bezeichnet. Er ist die EKG-Entsprechung der frühen Repolarisation, deren zellelektrophysiologisches Korrelat die Phase 1 (partielle Repolarisation) des Aktionspotentials ist. Während der ST-Strecke befinden sich die depolarisierenden und repolarisierenden Ströme im Gleichgewicht, ihr Korrelat ist Phase 2 (Plateauphase) des Aktionspotentials. Die T-Welle stellt im EKG die Erregungsrückbildung dar, ihr wird Phase 3 (Repolarisation) des Aktionspotentials zugeordnet.
Erregungsrückbildung im EKG
Es gibt kein spezifisches Erregungsrückbildungssystem. Ventrikuläre Kardiomyozyten repolarisieren nicht synchron, sondern quasi zufallsverteilt. Die T-Welle entspricht daher in grober Näherung einer leicht asymmetrischen Gauß'schen Glocke (Gauß-Verteilung), mit einer Schiefe nach rechts. Wird die Erregungsrückbildung durch verbesserte Kaliumleitfähigkeit erleichtert, repolarisiert die Gesamtheit der Kardiomyozyten in kürzerer Zeit und führt zu einer schmaleren und größeren T-Welle (mehr dazu unter Kalium).